วันอาทิตย์ที่ 27 สิงหาคม พ.ศ. 2560
วันเสาร์ที่ 26 สิงหาคม พ.ศ. 2560
บทที่ 3 สมบัติของธาตุและสารประกอบ
สมบัติของสารประกอบของธาตุตามคาบ
- สมบัติของสารประกอบคลอไรด์ของธาตุในคาบ 2 และ 3
สารประกอบดลอไรด์
คุณสมบัติ |
สารประกอบคลอไรด์ของโลหะ
|
สารประกอบคลอไรด์ของอโลหะ
|
จุดเดือด
|
สูง
|
ต่ำ
|
จุดหลอมเหลว
|
สูง
|
ต่ำ
|
ความเป็นกรด-เบสของสารละลาย
|
กลาง
ยกเว้นBeCl2 และ NaCl3 ซึ่งป็นกรด |
กรด
|
สารที่ไม่ละลายน้ำ
|
CCl4 NCl5
|
-
|
- สมบัติของสารประกอบออกไซด์ของธาตุในคาบ 2 และ 3
สารประกอบออกไซด์
คุณสมบัติ |
สารประกอบออกไซด์ของโลหะ
|
สารประกอบออกไซด์ของอโลหะ
|
จุดเดือด
|
สูง
|
ต่ำ
|
จุดหลอมเหลว
|
สูง
|
ต่ำ
|
ความเป็นกรด-เบสของสารละลาย
|
เบส
|
กรด
|
สารที่ไม่ละลายน้ำ
|
BeO Al3O3
|
SiO2
|
ธาตุหมู่ I โลหะอัลคาไลน์ 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 1 2. มีเลขออกซิเดชัน +1
3. ทำปฏิกิริยาได้ดีมาก จึงไม่พบโลหะหมู่ I ในธรรมชาติ แต่จะพบในสารประกอบ สารประกอบทุกตัวเป็นพันธะไอออนิก 4. สารประกอบของโลหะหมู่ I ละลายน้ำได้ทุกตัว5. ทำปฏิกิริยารุนแรงกับน้ำ ได้ด้างและแก๊ส H2
6. ความหนาแน่นต่ำ ลอยน้ำได้ จุดเดือด จุดหลอมเหลว ไม่สูงนัก
1. มีเวเลนส์อิเล็กตรอนเท่ากับ 2 2. มีเลขออกซิเดชัน +2
3.ทำปฏิกิริยาได้ดี พบโลหะหมู่ II ในธรรมชาติและพบในรูปสารประกอบ สารประกอบส่วนใหญ่เป็นพันธะไอออนิก ยกเว้น Be
4. สารประกอบของโลหะหมู่ II ส่วนใหญ่ ละลายน้ำได้ดี แต่จะไม่ละลายน้ำถ้าเป็นสารประกอบของ CO32- SO42- PO43- ยกเว้น MgSO4
5. ทำปฏิกิริยากับน้ำ ได้ด่างและแก๊ส H2
ธาตุหมู่ VI ชาลโคเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 6
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -2 ถึง+6
3. จุดเดือด จุดหลอมเหลวสูงมากเมื่อเทียบกับหมู่VII ส่วนใหญ่เป็นสารประกอบประเภทโครงร่างตาข่าย
ธาตุหมู่ VII เฮโลเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 7
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -1 ถึง +7
3. เป็นธาตุหมู่เดียวที่1 โมเลกุล มี 2 อะตอมเรียกว่า Diatomic Molecule
4. พบเป็นธาตุอิสระในธรรมชาติ และพบในรูปของสารประกอบไอออนิกและโคเวเลนต์5. สารประกอบของหมู่ VII ส่วนใหญ่ละลายน้ำได้ดี ยกเว้นเป็นสารประกอบของ Ag Hg Pb
ธาตุหมู่ VIII แก๊สเฉื่อย , แก๊สมีตระกูล , Inert gas , Noble gas1. มีเวเลนส์อิเล็กตรอนเท่ากับ 8 ยกเว้น He มีเท่ากับ 22. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -2 ถึง+6
3. จุดเดือด จุดหลอมเหลวสูงมากเมื่อเทียบกับหมู่VII ส่วนใหญ่เป็นสารประกอบประเภทโครงร่างตาข่าย
ธาตุหมู่ VII เฮโลเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 7
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -1 ถึง +7
3. เป็นธาตุหมู่เดียวที่1 โมเลกุล มี 2 อะตอมเรียกว่า Diatomic Molecule
4. พบเป็นธาตุอิสระในธรรมชาติ และพบในรูปของสารประกอบไอออนิกและโคเวเลนต์5. สารประกอบของหมู่ VII ส่วนใหญ่ละลายน้ำได้ดี ยกเว้นเป็นสารประกอบของ Ag Hg Pb
2. เฉื่อยชาต่อการเกิดปฏิกิริยามาก แต่สามารถสังเคราะห์ได้
3. มีค่า IE (Ionization Energy) สูงสุดในตาราง และ He มีค่า IE สูงที่สุดในตารางธาตุ 4. เป็นธาตุเดียวที่ไม่มีค่า EN
ตำแหน่งของธาตุไฮโดรเจนในตารางธาตุ
การจัดธาตุให้อยู่ในหมู่ของตารางธาตุจะใช้สมบัติที่คล้ายกันเป็นเกณฑ์
การจัดธาตุให้อยู่ในหมู่ของตารางธาตุจะใช้สมบัติที่คล้ายกันเป็นเกณฑ์
สมบัติ
|
ธาตุหมู่ IA
|
ธาตุไฮโรเจน
|
ธาตุหมู่ VIIA
|
จำนวนวาเลนซ์อิเล็กตรอน
|
1
|
1
|
7
|
เลขออกซิเดชันในสารประกอบ
|
+1
|
+1และ-1
|
+1 +3 +5 +7 -1
|
ค่า IE
|
382-526
|
1318
|
1015-1687
|
อิเล็กโทรเนกาติวิตี
|
1.0-0.7
|
2.1
|
4.0-2.2
|
สถานะ
|
ของแข็ง
|
แก๊ส
|
แก๊ส/ของเหลว/ของแข็ง
|
การนำไฟฟ้า
|
นำ
|
ไม่นำ
|
ไม่นำ
|
สรุป ธาตุไฮโดรเจนมีสมบัติคล้ายหมู่ VIIA หลายหระการ แต่ไม่สามารถนำธาตุไฮโดรเจนมาจัดในหมู่ VIIA ได้ เพราะ จะทำให้แนวโน้มของสมบัติบางประการของธาตุหมู่VIIA เสียไป ปัจจุบันจึงจัดธาตุไฮโดรเจน อยู่ในคาบที่ 1 อยู่ระหว่างหมู่ IA กับ VIIA
ธาตุทรานซิชัน
ธาตุทรานซิชัน ประกอบด้วยธาตุ หมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มแลนทาไนด์กับกลุ่มแอกทิไนด์
1. อยู่ระหว่างหมู่IIA กับหมู่ IIIA เริ่มตั้งแต่คาบ 4 เริ่มที่เลขอะตอม 21
2.การจัดเรียงอิเล็กตรอนจะต่างจากธาตุโดยทั่วไป คือ จะจัดเรียงอิเล็กตรอนวงนอกสุดก่อน แล้วจัดอิเล็กตรอนวงรองจากวงนอกสุดเป็นวงสุดท้าย3.การดึงอิเล็กตรอนให้หลุดจากอะตอม จะดึงอิเล็กตรอนวงนอกสุดก่อน เช่นเดียวกับธาตุปกติ4.ธาตุทรานซิชัน จะมีเวเลนต์อิเล็กตรอน เป็น 2,1 เท่านั้น ยกเว้น Cr กับ Cu มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
5.ธาตุทรานซิชัน จะมีสมบัติเหมือนกันเป็นคาบมากกว่าเป็นหมู่
6.ความหนาแน่นของธาตุทรานซิชันจะสูงมาก และในคาบเดียวกันจะมีความหนาแน่นที่ใกล้เคียงกัน
7.จุดเดือดและจุดหลอมเหลวของธาตุทรานซิชันจะสูงมาก และสูงมากกว่าหมู่IAและหมู่IIA
8.ค่า IE , EN , E0 ของธาตุทรานซิชันจะสูงมากกว่าโลหะโดยทั่วไป9.ขนาดอะตอมของธาตุทรานซิชันที่เรียงตามคาบจากซ้ายไปขวาจะมีขนาดเล็กลง แต่ใกล้เคียงกันมาก เพราะโลหะทรานซิชัน มีความหนาแน่นสูง 10.ธาตุทรานซิชัน มีเลขออกซิเดชันหลายค่า ยกเว้น Sc กับ Zn มีเลขออกซิเดชันเพียงค่าเดียว
ธาตุทรานซิชัน ประกอบด้วยธาตุ หมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มแลนทาไนด์กับกลุ่มแอกทิไนด์
1. อยู่ระหว่างหมู่IIA กับหมู่ IIIA เริ่มตั้งแต่คาบ 4 เริ่มที่เลขอะตอม 21
2.การจัดเรียงอิเล็กตรอนจะต่างจากธาตุโดยทั่วไป คือ จะจัดเรียงอิเล็กตรอนวงนอกสุดก่อน แล้วจัดอิเล็กตรอนวงรองจากวงนอกสุดเป็นวงสุดท้าย3.การดึงอิเล็กตรอนให้หลุดจากอะตอม จะดึงอิเล็กตรอนวงนอกสุดก่อน เช่นเดียวกับธาตุปกติ4.ธาตุทรานซิชัน จะมีเวเลนต์อิเล็กตรอน เป็น 2,1 เท่านั้น ยกเว้น Cr กับ Cu มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
5.ธาตุทรานซิชัน จะมีสมบัติเหมือนกันเป็นคาบมากกว่าเป็นหมู่
6.ความหนาแน่นของธาตุทรานซิชันจะสูงมาก และในคาบเดียวกันจะมีความหนาแน่นที่ใกล้เคียงกัน
7.จุดเดือดและจุดหลอมเหลวของธาตุทรานซิชันจะสูงมาก และสูงมากกว่าหมู่IAและหมู่IIA
8.ค่า IE , EN , E0 ของธาตุทรานซิชันจะสูงมากกว่าโลหะโดยทั่วไป9.ขนาดอะตอมของธาตุทรานซิชันที่เรียงตามคาบจากซ้ายไปขวาจะมีขนาดเล็กลง แต่ใกล้เคียงกันมาก เพราะโลหะทรานซิชัน มีความหนาแน่นสูง 10.ธาตุทรานซิชัน มีเลขออกซิเดชันหลายค่า ยกเว้น Sc กับ Zn มีเลขออกซิเดชันเพียงค่าเดียว
สารประกอบของธาตุทรานซิชัน
1.การเกิดสี1.สีของธาตุทรานซิชันจะเปลี่ยนเมื่อเลขออกซิเดชันเปลี่ยน เช่น
สูตร
|
ชื่อ
|
สี
|
Cr2+
|
โครเมียม(II)ไอออน
|
น้ำเงิน
|
Cr3+
|
โครเมียม(III)ไอออน
|
เขียว
|
CrO42-
|
โครเมตไอออน
|
เหลือง
|
Cr2O72-
|
ไดโครเมตไอออน
|
ส้ม
|
Mn2+
|
แมงกานีส(II)ไอออน
|
ชมพูอ่อน, ไม่มีสี
|
Mn(OH)3*
|
แมงกานีส(III)ไฮดรอกไซด์
|
น้ำตาล
|
MnO2*
|
แมงกานีส(IV)ออกไซด์
|
ดำ
|
MnO42-
|
แมงกาเนตไอออน
|
เขียว
|
MnO4-
|
เปอร์แมงกาเนตไอออน
|
ม่วงแดง
|
2.สีจะเปลี่ยนถ้าสารหรือไอออนต่างชนิดกันมาล้อมรอบ เช่นCuSO4.5H2O สีฟ้า และ Cu(NH3)4SO4 สีคราม
3.สีเปลี่ยนเพราะจำนวนสารที่มาเกาะไม่เท่ากัน เช่น CrO42-สีเหลือง และ Cr2O72-
2.สารประกอบเชิงซ้อนของธาตุทรานซิชัน
สารประกอบของธาตุทรานซิชันชนิดต่างๆ เช่น KMnO4 ประกอบด้วย K+ และ MnO-4 ซึ่ง MnO-4 จัดเป็นไอออนเชิงซ้อน ที่มีธาตุทรานซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆที่มาล้อมรอบด้วยพันธะโคเวเลนต์
สารประกอบที่ประกอบด้วยไอออนเชิงซ้อนจัดเป็นสารประกอบเชิงซ้อน ธาตุทรานซิชันส่วนใหญ่จะเกิดเป็นสารประกอบเชิงซ้อนที่มีสีต่างกัน
ปัจจัยที่มีผลต่อสีของสารประกอบเชิงซ้อนของธาตุทรายซิชัน
- เลขออกซิเดชันของธาตุทรานซิชัน - ชนิดของธาตุทรานซิชัน
- จำนวนโมเลกุลหรือไอออนที่ล้อมรอบธาตุทรานซิชัน
ธาตุกึ่งโลหะ
มีคุณสมบัติดังนี้1.มีค่า IE และ EN ค่อนข้างสูง
2.จุดเดือด จุดหลอมเหลว สูง
3.มีความหนาแน่นสูง
4.สามารถนำไฟฟ้าได้
5.สามารถเกิดสารประกอบได้ ทั้งสารประกอบไอออนนิกและสารประกอบโคเวเลนต์
ธาตุกำมันตรังสี
ธาตุกัมมันตรังสี คือ ธาตุที่มีสมบัติในการแผ่รังสีกัมมันตภาพรังสี คือ ปรากฏการณ์ที่ธาตุแผ่รังสีได้อย่างต่อเนื่อง
การแผ่รังสี เป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโทปที่ ไม่เสถียร(ไอโซโทปของนิวเคลียสที่มีอัตราส่วนระหว่างจำนวนนิวตรอนต่อจำนวนโปรตอนไม่เหมาะสม) เนื่องจากนิวเคลียสของธาตุกัมมันตรังสีมีพลังงานสูงมากและไม่เสถียร จึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีบางชนิด แล้วธาตุเหล่านั้นก็จะเปลี่ยนเป็นธาตุใหม่
ชนิดและสมบัติของรังสีบางชนิด
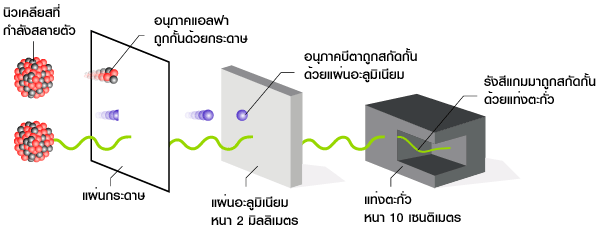
รังสีแอลฟาหรือ อนุภาคแอลฟา
- อนุภาคประกอบด้วย 2 โปรตอน 2 นิวตรอน เหมือนนิวเคลียสของอะตอมฮีเลียม มีเลขมวล 4
- มีประจุไฟฟ้า +2
- มีอำนาจทะลุทะลวงต่ำมาก ไม่สามารถผ่านแผ่นกระดาษหรือโลหะบางๆได้
- เบี่ยงเบนในสนามแม่เหล็ก โดยเบนเข้าหาขั่วลบ
รังสีบีตา หรือ อนุภาคบีตา
- มีสมบัติเหมือนอิเล็กตรอน
- มีประจุไฟฟ้า -1 มีมวลเท่ากับมวลอิเล็กตรอน
- มีอำนาจทะลุทะลางมากกว่า รังสีแอลฟา ถึง 100 เท่า สามารถผ่านโลหะแผ่นบางๆ
- มีความเร็วใกล้เคียงความเร็วแสง
- เบี่ยงเบนในสนามแม่เหล็ก โดยเบนเข้าหาขั่วบวก
รังสีแกมมา
- เป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก
- ไม่มีประจุไม่มีมวล
- มีอำนาจทะลุทะลวงสูงมาก สามารถผ่านแผ่นคอนกรีตหนาๆได้
ครึ่งชีวิตของธาตุกัมมันตรังสี
ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต(ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม) ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ประโยชน์ของธาตุกัมมันตรังสี
ด้านธรณีวิทยา
C-14 หาอายุของวัตตุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์
I-131 ตรวจดูความปกติของต่อมไธรอยด์
I-132 ตรวจดูภาพสมอง
Na-24 ตรวจดูระบบการไหลเวียนของเลือด
Co-60,Ra-226 รักษาโรคมะเร็ง
P-32 รักษาโรคมะเร็งเม็ดเลือดขาว
ด้านการเกษตร
P-32 ตรวจวัดรังสีที่ใบของพืช
ปรับปรุงเมล็ดพันธุ์พืช
Co-60 ทำลายแบคทีเรีย,ถนอมอาการ
ด้านการอุสาหกรรม
รังสีทำให้อัญมณีมีสีสันสวยงามขึ้น
ตรวจหารอยรั่วของท่อส่งน้ำมัน
ด้านพลังงาน
ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต(ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม) ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ประโยชน์ของธาตุกัมมันตรังสี
ด้านธรณีวิทยา
C-14 หาอายุของวัตตุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์
I-131 ตรวจดูความปกติของต่อมไธรอยด์
I-132 ตรวจดูภาพสมอง
Na-24 ตรวจดูระบบการไหลเวียนของเลือด
Co-60,Ra-226 รักษาโรคมะเร็ง
P-32 รักษาโรคมะเร็งเม็ดเลือดขาว
ด้านการเกษตร
P-32 ตรวจวัดรังสีที่ใบของพืช
ปรับปรุงเมล็ดพันธุ์พืช
Co-60 ทำลายแบคทีเรีย,ถนอมอาการ
ด้านการอุสาหกรรม
รังสีทำให้อัญมณีมีสีสันสวยงามขึ้น
ตรวจหารอยรั่วของท่อส่งน้ำมัน
ด้านพลังงาน
U-235,U-238,Pu-239 ผลิตไฟฟ้าในโรงไฟฟ้าปรมาณู
โทษของธาตุกัมมันตรังสี
เมื่อร่างกายได้รับรังสีจำนวนมากทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่างๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ไม่สามารถทำงานได้ตามปกติ อาจทำให้เซลล์เกิดการเปลี่ยนแปลงหรือกลายพันธุ์ และรังสีแอลฟาจะทำลายเซลล์เม็ดเลือดแดง
ปฏิกิริยานิวเคลียร์
เป็นการเปลี่ยนแปลง ในนิวเคลียสของธาตุ และมีพลังงานเกี่ยวข้องกับปฏิกิริยาจำนวนมหาศาล
ปฏิกิริยาฟิชชัน
คือ กระบวนการที่นิวเคลียสของธาตุหนักบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่า ในการเกิดปฏิกิริยาในแต่ละครั้งจะคายพลังงานออกมาจำนวนมาก และได้ไอโซโทปกัมมันตรังสีหลายชนิด รวมถึงได้นิวตรอน ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นๆ ก็จะทำให้เกิดปฏิกิริยาฟิชชันต่อไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
เมื่อร่างกายได้รับรังสีจำนวนมากทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่างๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ไม่สามารถทำงานได้ตามปกติ อาจทำให้เซลล์เกิดการเปลี่ยนแปลงหรือกลายพันธุ์ และรังสีแอลฟาจะทำลายเซลล์เม็ดเลือดแดง
ปฏิกิริยานิวเคลียร์
เป็นการเปลี่ยนแปลง ในนิวเคลียสของธาตุ และมีพลังงานเกี่ยวข้องกับปฏิกิริยาจำนวนมหาศาล
ปฏิกิริยาฟิชชัน
คือ กระบวนการที่นิวเคลียสของธาตุหนักบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่า ในการเกิดปฏิกิริยาในแต่ละครั้งจะคายพลังงานออกมาจำนวนมาก และได้ไอโซโทปกัมมันตรังสีหลายชนิด รวมถึงได้นิวตรอน ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นๆ ก็จะทำให้เกิดปฏิกิริยาฟิชชันต่อไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
ปฏิกิริยาฟิวชัน
คือ กรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิม และให้พลังงานปริมาณมาก การเกิดปฏิกิริยาฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้ารวมกัน
คือ กรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิม และให้พลังงานปริมาณมาก การเกิดปฏิกิริยาฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้ารวมกัน
ตารางธาตุ (Periodic table)

พลังงานไอออไนเซชัน (IE)
พลังงานไอออไนเซชัน คือ พลังงานที่ใช้ในการดึงอิเล็กตรอน 1 อนุภาค ออกจากอะตอมในสถานะแก๊ส กลายเป็นไอออนบวก
ธาตุที่มีอิเล็กตรอน 1 ตัวคือ ธาตุไฮโดรเจน (H)
H(g) → H+(g) + e- IE=1,318 kJ/mol
อิเล็กโตรเนกาติวิตี (EN)
คือ ค่าที่แสดงความสามารถในการดึงอิเล็กตรอนของอะตอมของธาตุในพันธะเคมีหนึ่ง อะตอมที่มีค่า ENสูงจะดึงดูดอิเล็กตรอนได้ดีกว่าอะตอมที่มีค่า EN ตำ
อิเลกตรอนอัฟฟินิตี (EA) (สัมพรรคอิเล็กตรอน)
คือ ระดับพลังงานที่ใช้ในการดึงอิเล็กตรอนออกจากอิออนลบในสถานะก๊าช แล้วกลายเป็นอะตอมในสถานะก๊าช
Cl - (g) → Cl (g) + e ดูด
หรือพลังงานที่คายออกมา เมื่ออะตอมในสถานะก๊าชรับอิเล็กตรอน แล้วกลายเป็นอิออนในสถานะก๊าช
Cl (g) + e → Cl- (g) คาย
จุดหลอมเหลวและจุดเดือด (Melting point , Boiling point)
สารต่าง ๆ จะมีแรงยึดเหนี่ยวระหว่างอนุภาค ซึ่งขึ้นอยู่กับว่าสารนั้น ๆ อยู่ในรูปโมเลกุลหรืออะตอม ความแข็งแรงของแรงยึดเหนี่ยวระหว่างอนุภาคจะมีผลต่อจุดหลอมเหลวและจุดเดือด สารที่ที่มีแรงยึดเหนี่ยวระหว่างอนุภาคแข็งแรงมากจุดหลอมเหลวและจุดเดือดจะสูง ส่วนสารที่มีแรงยึดเหนี่ยวระหว่างอนุภาคแข็งแรงน้อย จุดหลอมเหลวและจุดเดือดจะต่ำ
1. แนวโน้มจุดหลอมเหลวและจุดเดือดตามคาบ
เมื่อพิจารณาตามคาบ ธาตุหมู่ IA IIA IIIA และ IVA จุดหลอมเหลวและจุดเดือดมีแนวโน้มสูงขึ้นตามลำดับ โดยเฉพาะหมู่ IVA จะมีจุดหลอมเหลวและจุดเดือดสูงที่สุด ส่วนหมู่ VA VIA VIIA และ VIIIA จุดหลอมเหลวและจุดเดือดต่ำ
2. แนวโน้มจุดหลอมเหลวและจุดเดือดตามหมู่
เมื่อพิจารณาตามหมู่พบว่าจุดหลอมเหลวและจุดเดือดของธาตุหมู่ IA IIA และ IIIA ส่วนใหญ่มีค่าลดลงเมื่อมีเลขอะตอมเพิ่มขึ้น หรือมีแนวโน้มลดลงจากบนลงล่างตามหมู่ เนื่องจากมีขนาดอะตอมใหญ่ขึ้น ความแข็งแรงของพันธะโลหะจะลดลงตามหมู่ ส่วนธาตุหมู่ VA VIA VIIA และ VIIIA มีจุดหลอมเหลวและจุดเดือดเพิ่มขึ้นตามเลขอะตอม ซึ่งเป็นผลมาจากมีมวลอะตอมเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุล (แรงแวนเดอร์วาลส์) มีค่ามากขึ้น สำหรับจุดหลอมเหลวและจุดเดือดของธาตุหมู่ IVA มีแนวโน้มที่ไม่ชัดเจน เนื่องจากธาตุหมู่ IVA มีโครงสร้างและแรงยึดเหนี่ยวระหว่างอะตอมแตกต่างกัน จึงไม่สามารถสรุปแนวโน้มได้
เลขออกซิเดชัน (Oxidation number)
หมายถึงจำนวนประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ
เกณฑ์การกำหนดค่าเลขออกซิเดชัน มีเกณฑ์ดังนี้
1.ธาตุอิสระทุกชนิดทั้งที่อยู่ในรูปอะตอมหรือโมเลกุล มีเลขออกซิเดชันเท่ากับศูนย์ เช่น Fe , Zn , H2 , N2 , O2 , P4 , S8 ต่างมีเลขออกซิเดชันเท่ากับศูนย์
2. ออกซิเจนในสารประกอบทั่วไปมีเลขออกซิเดชัน -2 ยกเว้นในสารประกอบเปอร์ออกไซด์ เช่น Na2O2 , H2O2 , BaO2 ออกซิเจนมีเลขออกซิเดชัน -1 ในสารประกอบซูเปอร์ออกไซด์ เช่น KO2 ออกซิเจนมีเลขออกซิเดชัน -1/2 ในสารประกอบ OF2 ออกซิเจนมีเลขออกซิเดชัน +2
3. ไฮโดรเจนในสารประกอบทั่วไปมีเลขออกซิเดชัน +1 ยกเว้นในสารประกอบโลหะไฮไดรด์ เช่น NaH ไฮโดรเจนมีเลขออกซิเดชัน -1
4. ไอออนของธาตุมีเลขออกซิเดชันเท่ากับประจุของไอออนนั้น เช่น H+ เลขออกซิเดชันเท่ากับ +1 , Ca2+ เลขออกซิเดชันเท่ากับ +2 , Cl- เลขออกซิเดชันเท่ากับ -1 เป็นต้น
5. ไอออนที่ประกอบด้วยอะตอมมากกว่า 1 ชนิด ผลรวมของเลขออกซิเดชันของทุกอะตอมเท่ากับประจุของไอออนนั้น เช่น Cr2O7 2- มีประจุ -2 ผลรวมของเลขออกซิเดชันของ Cr2O7 2- จึงเท่ากับ -2
6. ในสารประกอบใด ผลรวมของเลขออกซิเดชันของทุกอะตอมเท่ากับศูนย์ เช่น CaO เลขออกซิเดชันของแคลเซียมเท่ากับ +2 ของออกซิเจนเท่ากับ -2 ซึ่งรวมกันจะเท่ากับศูนย์
ตัวอย่างที่ จงหาเลขออกซิเดชันของ Mn ในสารประกอบ KMnO4
ผลรวมเลขออกซิเดชันของ KMnO4
|
=
|
0
|
K + Mn + 4(O)
|
=
|
0
|
(+1) + Mn + 4(-2)
|
=
|
0
|
Mn
|
=
|
(+8) - 1
|
=
|
+7
|
การจัดเรียงอิเล็กตรอน
|
สมัครสมาชิก:
ความคิดเห็น (Atom)